Question de méthodes : Mesure et manipulation des hormones sexuelles chez les animaux de laboratoire
Numéro 1 — Août 2020

En science fondamentale, les hormones sexuelles de la souris et du rat peuvent être mesurées et manipulées au moyen d’une variété de techniques. Nous nous sommes entretenues avec Margaret McCarthy, Ph.D., professeure de pharmacologie de l’Université du Maryland, pour connaître son opinion sur la meilleure façon d’intégrer ces méthodes à ses recherches. Les recherches de Margaret McCarthy portent sur l’influence des hormones sexuelles dans le développement du cerveau, plus particulièrement sur la compréhension des mécanismes cellulaires qui établissent les différences liées au sexe. Voici ses recommandations :
À quel moment une étude sur la souris femelle et la rate devrait-elle reproduire le cycle œstral ?
Vous devez commencer par faire abstraction de ce cycle. Examinez vos données et voyez s’il y a une variabilité dans vos groupes expérimentaux mâles et femelles. La variabilité chez le mâle peut être causée par le fait qu’il vit en groupe, ce qui peut modifier les taux de stéroïdes chez la souris et le rat.Apprenez-en davantage (en anglais seulement).Note en bas de page 1
Si la variabilité chez le mâle est faible, mais qu’elle est élevée chez la femelle, il est conseillé de reproduire le cycle œstral pour voir si celui-ci est une source de variabilité. Pour ce faire, il faut déterminer et surveiller l’étape du cycle œstral par observation visuelle ou cytologie vaginale sur deux semaines afin de découvrir l’importance des changements de taux d’œstrogène et de progestérone pour vos critères d’évaluation expérimentaux. Apprenez-en davantage (en anglais seulement).Note en bas de page 2
CONSEIL : La dynamique du cycle œstral peut varier selon les différentes souches de souris et de rats.
Quelles méthodes recommandez-vous pour quantifier les taux d’hormones sexuelles chez la souris et le rat ?
Il existe plusieurs méthodes qui peuvent être utilisées pour mesurer les taux d’androgènes, d’œstrogènes et de progestérone. Tenez compte des avantages et des limites de chaque méthode et déterminez celle qui convient le mieux à votre recherche.
| Méthode | Avantages | Limites |
|---|---|---|
| ELISA |
|
|
| RIA |
|
|
| GC-MS |
|
|
Quelles méthodes recommandez-vous pour manipuler les hormones sexuelles chez la souris et le rat, mâle et femelle ?
Une fois que la différence liée au sexe est connue, il existe plusieurs méthodes pour déterminer si l’effet est induit par les hormones sexuelles :
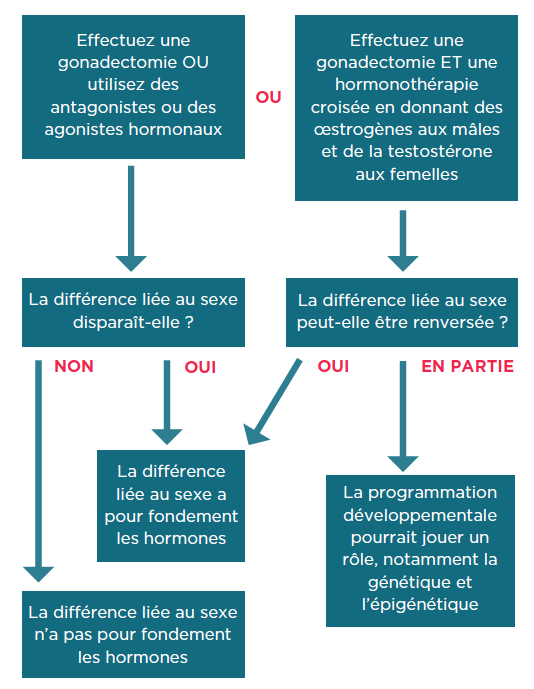
Descriptions détaillées
- Effectuez une gonadectomie OU utilisez des antagonistes ou des agonistes hormonaux
- Est-ce que la différence liée au sexe disparaît ?
- Si oui, la différence liée au sexe a pour fondement les hormones
- Si non, la différence liée au sexe n’a pas pour fondement les hormones
- Est-ce que la différence liée au sexe disparaît ?
OU
- Effectuez une gonadectomie ET une hormonothérapie croisée en donnant des œstrogènes aux mâles et de la testostérone aux femelles
- Est-ce que la différence liée au sexe peut être renversée ?
- Si oui, la différence liée au sexe a pour fondement les hormones
- Si c’est en partie, la programmation développementale pourrait jouer un rôle, notamment la génétique et l’épigénétique
- Est-ce que la différence liée au sexe peut être renversée ?
Quel protocole recommandez-vous pour reproduire le cycle œstral chez la souris et le rat après une gonadectomie ?
Attendez une semaine après la gonadectomie avant d’administrer des hormones sexuelles exogènes. Les hormones circulantes disparaîtront en 24 heures, mais il faut laisser suffisamment de temps pour que les hormones soient supprimées au niveau des tissus. N’attendez pas trop longtemps sinon les récepteurs seront perturbés ! Le protocole sera différent si vous utilisez des souris ou des rats, et il dépendra de l’étape du cycle œstral que vous souhaitez reproduire.
CONSEIL : Les antagonistes de l’hormone de libération des gonadotrophines (p. ex. l’acyline) ou des œstrogènes (p. ex. le tamoxifène) sont des solutions de rechange convenables à la gonadectomie !
Rats
Chez le rat, les injections en sous-cutané peuvent être faites sur une période de deux jours pour reproduire raisonnablement le cycle œstral. Pour mesurer le diœstrus, injectez 0,3 µg de benzoate d’œstradiol quelques heures avant le critère d’évaluation expérimental.Note en bas de page 3 Pour mesurer le proœstrus, injectez entre 1 à 10 µg de benzoate d’œstradiol quelques heures avant le critère d’évaluation expérimental.Note en bas de page 3Note en bas de page 4. Si vous voulez maintenir une stimulation du cycle œstral pour une période prolongée, injectez (en sous-cutané) 2 µg de benzoate d’œstradiol tous les quatre jours. Pour mesurer la stimulation ou le comportement sexuel, vous devrez injecter 10 µg de benzoate d’œstradiol, deux jours de suite. Vous passez ensuite une journée et administrez une injection de 1 mg de progestérone et vous faites un test quatre heures plus tard, en vous assurant que le test est fait en après-midi, au cours de la phase sombre du cycle.Note en bas de page 5
Souris
Chez la souris, il n’est pas possible de faire des injections pour reproduire le cycle œstral. Il faut plutôt implanter sous la peau une capsule qui libérera continuellement de l’œstradiol pendant une semaine ou deux pour obtenir des taux d’œstradiol constamment élevés avant qu’elle ne devienne sexuellement réceptive. Cela permettra de déterminer si les œstrogènes ont un effet modérateur. Si ce n’est pas le cas, il faudra alors faire une injection de progestérone en plus du taux d’œstradiol élevé continu pour voir si la progestérone a un effet modérateur. La progestérone aura un effet en quatre à six heures.
Selon vous, quelle est la meilleure méthode pour administrer des hormones exogènes à une souris et à un rat ?
Plusieurs approches peuvent être adoptées. Tenez compte des avantages et des limites de chaque méthode et déterminez celle qui convient le mieux à votre recherche.
| Méthode | Avantages | Limites |
|---|---|---|
| Injection |
|
|
| Pellet |
|
|
| Implant en Silastic |
|
|
Quels autres conseils pouvez-vous donner aux spécialistes des sciences fondamentales ?
Gardez en tête que les bioessais qui se sont montrés efficaces dans le passé peuvent être utilisés en tant que marqueurs de substitution des taux d’hormones sexuelles.
| Chez le mâle, le poids de la glande séminale peut être un bon indicateur du taux d’androgènes. Plus le poids est élevé, plus le seront les taux d’androgènes. | Chez la femelle, le poids de l’utérus peut être utilisé comme indicateur du taux d’œstrogènes chez la souris femelle et la rate qui ne sont pas gestantes. Plus le poids est élevé, plus le seront les taux d’œstrogènes. |
Les opinions exprimées dans ce document sont celles de Margaret McCarthy et ne reflètent pas nécessairement celles de l'Institut de la santé des femmes et des hommes des IRSC ou du gouvernement du Canada.
- Date de modification :