Séquencer l’avenir : Plan stratégique de l’institut de génétique 2022-2027
Engagement A : Faciliter la médecine génomique
Engagement A : Faciliter la médecine génomique

La médecine génomique est à l’aube d’un système de santé apprenant où les informations sur les patients alimentent la recherche, qui à son tour façonne les soins cliniques. Ce système (voir la boucle infinie, figure 1.1) déterminera avec de plus en plus d’exactitude ce qui, dans le génome, nous maintient en bonne santé, et ce qui nous rend malades ou nous prédispose à la maladie. L’utilisation de la génomique pour classifier les maladies héréditaires et acquises est déjà une réalité. L’augmentation du nombre de personnes au Canada dont le génome est séquencé et analysé se traduira par des retombées toujours plus importantes sur les soins de santé.
L’élaboration d’une stratégie commune de production, de stockage, de consultation et d’échange de l’information génomique est une étape nécessaire et déterminante pour améliorer la santé des résidents du Canada par la génomique.
Étapes initiales
L’élaboration d’une telle stratégie passe nécessairement par la centralisation des données sur les génomes séquencés au Canada. Une structure de gouvernance permettra d’établir un ensemble commun de normes pour assurer l’interopérabilité des données, gérer l’accès aux données et régler les questions éthiques et juridiques, tout en gérant l’infrastructure des données et la puissance informatique. La mobilisation du public et des patients dès le début autour de questions comme la confidentialité et la sécurité sera indispensable. Cette mobilisation devra inclure des recherches centrées sur les besoins des patients et des communautés, ainsi que la participation de ces groupes à toutes les étapes des études, de la conception à l’application des résultats, en passant par l’exécution des travaux.
Pourquoi la génomique et pourquoi maintenant ? Tout simplement parce que le temps et le coût du séquençage d’un génome humain ont diminué avec le temps. En effet, il a fallu plus d’une décennie pour achever la première ébauche du génome humain en 2001 ; en 2021, ce travail prend moins d’une journée. Le coût quant à lui est passé de plus d’un milliard de dollars en 2001 à 50 000 $ en 2010, et s’établit à 750 $ aujourd’hui. Et il continue de baisser. Il va donc de soi que la recherche en génomique est de plus en plus intégrée aux soins cliniques et commence à être introduite dans les dossiers médicaux (médecine personnalisée). Pour mettre cette avancée en perspective, quelques centaines de milliers de génomes humains ont été séquencés dans le monde jusqu’à présent, et ce chiffre va augmenter de façon exponentielle, de sorte que plus de 60 millions de génomes humains devraient être séquencés d’ici à 2026.
Bibliothèque canadienne du génome humain : une richesse nationale
Une bibliothèque canadienne du génome humain gérée de manière responsable est une ressource indispensable pour la recherche et le milieu clinique. Elle sera conçue de telle manière que les efforts de séquençage du génome humain puissent s’arrimer en temps réel pour mettre en place un système de santé apprenant. Ainsi, le Canada sera mieux préparé à relever les défis posés par toute éclosion future de virus ou de bactéries multirésistantes aux médicaments. La création de cette bibliothèque représentera une initiative structurante et sera rendue possible par la conjugaison des forces des portefeuilles de la Santé et de l’Innovation, des Sciences et du Développement économique.
Vers une médecine prédictive et personnalisée
La boucle infinie de la recherche en génomique aux soins de santé
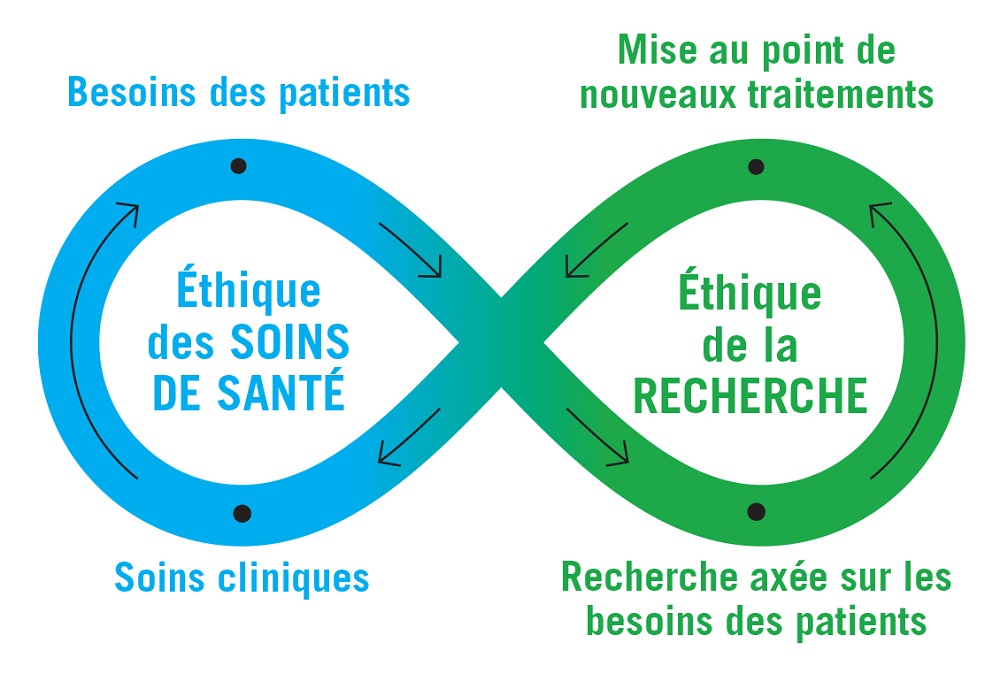
Description détaillée
Dans cette image de boucle infinie, des flèches indiquent la continuité des interactions entre les soins de santé et la recherche. À gauche se trouve l’éthique des soins de santé, accompagnée de deux points : les besoins des patients et les soins cliniques. À droite se trouve l’éthique de la recherche, elle aussi accompagnée de deux points : la mise au point de nouveaux traitements et la recherche axée sur les besoins des patients.
Les « besoins des patients » mènent à la « recherche axée sur les besoins des patients », qui alimente la « mise au point de nouveaux traitements », qui elle contribue à son tour aux « soins cliniques » pour finalement revenir aux « besoins des patients ».
Un avantage majeur de l’analyse du génome par rapport à de nombreux autres tests est que le génome d’une personne est normalement statique : il ne change pas au cours de sa vie. C’est un test qui n’est effectué qu’une seule fois (contrairement à la mesure de la tension artérielle, du taux de cholestérol, de la fonction cardiaque/cérébrale/hépatique, etc.) et dont le résultat peut être analysé et réanalysé tout au long de la vie d’une personne. Notre connaissance de ce qui, dans le génome, nous maintient en bonne santé et nous rend malades s’affine continuellement. Ce nouveau savoir peut être mis à profit à toutes les étapes de la vie, notamment par la réanalyse des génomes, des dossiers médicaux et d’autres sources de données pertinentes, augmentant ainsi la valeur du système de santé apprenant.
L’intégration croissante des séquences génomiques dans les données de santé et leur analyse permettra d’atteindre un objectif majeur de la médecine génomique : prévenir les maladies avant qu’elles ne se manifestent. À mesure que les ensembles de données génomiques se multiplient, les scores de risque polygénique permettront de prédire le risque de maladies courantes (cardiopathies et accidents vasculaires cérébraux, cancer, diabète, et bien d’autres) au niveau individuel. L’expansion constante des ensembles de données sur le génome et la santé permettra d’utiliser l’intelligence artificielle pour déterminer quelle combinaison de gènes prédispose une personne à une maladie particulière. Par ailleurs, l’introduction de nouvelles technologies omiques (capables de révéler des changements critiques dans les niveaux de protéines, de métabolites et d’autres marqueurs biologiques) se traduira par des prédicteurs de facteurs de risque de maladies encore plus précis. Ces informations pourront orienter une médecine axée sur la prévention, qui permettra de retarder ou de prévenir l’apparition d’une maladie chronique ou d’une affection aiguë (crise cardiaque, accident vasculaire cérébral, diabète, cancer, maladie mentale, etc.).
L’établissement de scores de risque polygénique exacts pour améliorer la prédiction du risque peut servir à prévenir des maladies courantes. Ces scores peuvent être incorporés dans les milieux cliniques de manière à réduire le fardeau des soins de santé et à augmenter l’espérance et la qualité de vie des résidents du Canada. À mesure que ce savoir modifie les soins de santé, les progrès doivent être mis en œuvre d’une manière qui mobilise les patients et le public. Il sera important de clarifier la façon dont les données seront utilisées et de respecter les exigences éthiques, juridiques et réglementaires pour garantir la confiance du public. La boucle infinie qui anime le système de santé apprenant de la génomique sera un exemple d’utilisation responsable des données sur la santé au profit des patients et de la société.
Prévenir les effets indésirables
La génomique peut non seulement prédire l’apparition de maladies, mais aussi améliorer l’innocuité des médicaments. Effectivement, la génétique peut permettre de prédire si un médicament particulier sera efficace pour un patient donné ou nuisible à sa santé. Environ 10 % des admissions dans les hôpitaux canadiens sont attribuables aux effets indésirables des médicaments, pour un séjour moyen d’une semaine. Or, en croisant la génomique avec la prescription de médicaments (ce qu’on appelle la pharmacogénomique), on peut réduire les effets indésirables, les admissions à l’hôpital et les coûts connexes, et s’assurer que seuls les patients qui ont le plus de chances de bénéficier d’un traitement le reçoivent.
Réponse aux menaces émergentes pour la santé
La génomique va au-delà des génomes humains et s’étend à d’autres organismes, le plus pertinent à l’heure actuelle étant le SRASCoV2, virus à l’origine de la COVID-19. Le rôle crucial de la génomique dans la lutte contre la COVID-19 réside dans le séquençage des génomes viraux chez les patients. Ce travail permet notamment de suivre la propagation des variants du SRAS-CoV-2 au pays et dans le monde, et aide à déterminer lesquels sont préoccupants, ou autrement dit, quelles souches sont plus virulentes, voire mortelles, que les autres. La surveillance des nouveaux variants préoccupants importés au Canada constitue une part essentielle du travail de recherche de contacts visant à détecter, et donc à réduire, la propagation des souches particulièrement virulentes.
En outre, le séquençage du génome des personnes infectées au Canada est indispensable à la détection et à la caractérisation rapides de tout variant « d’origine canadienne » potentiellement préoccupant. Une fois décelés, les variants préoccupants peuvent être analysés pour déterminer comment ils se propagent si rapidement, pourquoi ils sont si mortels ou s’ils peuvent échapper aux vaccins actuels.
Du côté de l’hôte humain, la réaction au SRASCoV-2 est variable, même parmi des personnes en bonne santé infectées par la même souche. Certaines personnes ne manifestent aucun symptôme ou présentent des symptômes bénins, tandis que d’autres perdent la vie. Le séquençage du génome de patients infectés approfondira notre compréhension des mécanismes biologiques en cause dans le degré de gravité de la maladie.
Il pourrait s’agir, par exemple, de la capacité du SRAS-CoV-2 à infecter les cellules, de sa capacité de réplication et de propagation dans l’organisme de l’hôte, ou encore de sa capacité à provoquer un choc cytokinique menant à la forme grave de la maladie ou au décès de l’hôte, ou alors à la COVID-19 de longue durée. Pour maximiser l’impact de la génomique dans l’offensive internationale contre la COVID-19, il est urgent de simplifier, d’accélérer et de faciliter l’échange de données génomiques, de données cliniques connexes et de grands ensembles de métadonnées à l’échelle nationale et internationale.
Échange international des données génomiques
L’application de la génomique en médecine suppose la mise en commun d’ensembles de données vastes et diversifiés, le recours à des outils éprouvés pour assurer la qualité, l’accessibilité et l’analyse des données, ainsi qu’une puissance informatique élevée. Au cours de la dernière décennie, l’Alliance mondiale pour la génomique et la santé (GA4GH) s’est imposée comme chef de file international de l’établissement de normes et d’un cadre commun pour faciliter l’échange de données génomiques et de santé à grande échelle entre pays. Ce travail a été l’un des principaux moteurs de la mise en commun des génomes des variants du SRAS-CoV-2 par de nombreux pays, dont le Canada. La communication rapide de données de haute qualité est essentielle à la compréhension des fondements scientifiques d’une intervention efficace et expéditive à toute pandémie.
Maintenant officiellement établie au Canada, la GA4GH continue d’entreprendre et de favoriser la création d’initiatives axées sur les données génomiques en contexte réel. Pour ce faire, il faut des outils et des normes pour l’échange des données génomiques, qui tiennent compte des dimensions réglementaires et éthiques. Ces outils et normes portent, entre autres, sur des enjeux comme le retour des résultats aux patients ainsi que la sécurité, l’accessibilité et l’échange des données.
Le cadre de la GA4GH pour l’échange responsable des données repose sur l’idée que la science et la société sont partenaires dans la détermination des principes d’échange des données. Ce cadre prend appui sur l’idée que chacun doit bénéficier de la science et de ses applications, comme le stipule l’article 27 de la Déclaration universelle des droits de l’homme de 1948. Le cadre étant désormais reconnu à l’échelle internationale comme une ressource essentielle, les projets de données internationaux tiennent compte des normes et des politiques de la GA4GH.
L’Institut de génétique des IRSC promet de veiller à ce que les normes et les principes de la GA4GH soient respectés de sorte que l’échange des données à l’échelle nationale et internationale maximise le potentiel de la génomique d’améliorer la santé et le bienêtre des personnes au Canada et partout dans le monde. Cette promesse s’inscrit dans le cadre de gestion des données de recherche du Canada, qui vise à créer des conditions favorables à la science ouverte et à la mise en commun des données. En effet, pour assurer un accès et une participation véritablement équitables au processus scientifique et aux retombées, le Canada doit rigoureusement maintenir des normes techniques et éthiques encadrant la mise en commun des données et des connaissances, maintenant et à l’avenir.
Faciliter la médecine génomique pour appuyer les priorités des IRSC
L’engagement de l’Institut de génétique en faveur du développement et de l’application de la médecine génomique cadre avec les cinq priorités des IRSC. Par la promotion de la science ouverte, le respect des principes FAIR et le soutien d’initiatives nationales transversales et de la collaboration internationale, cet engagement vise à « promouvoir l’excellence de la recherche dans toute sa diversité » (priorité A). En fournissant une structure essentielle pour répondre aux nouvelles menaces pour la santé, il permettra aussi de « renforcer la capacité de recherche en santé du Canada » (priorité B). Cet engagement vise en outre à réduire le « fossé génomique » et à améliorer le bien-être des Autochtones (Premières Nations, Métis, Inuits) en créant un écosystème qui soutient l’autodétermination et la gouvernance autochtones (priorité C). De plus, en soutenant fermement la définition des déterminants de la santé, il ouvrira la voie à une médecine axée sur la prévention (priorité D). Enfin, l’essentiel de cet engagement consiste à contribuer à l’édification d’un véritable système de santé apprenant (priorité E).
- Précédent - Introduction
- Suivant - Engagement B : Améliorer le diagnostic et le traitement des maladies génétiques
- Date de modification :