Recherche sur les maladies rares : percer le mystère de la maladie de Batten

Les maladies neurodégénératives touchent des millions de personnes dans le monde et, même si nous associons souvent ce type de maladie au vieillissement, ce n’est pas toujours le cas. Certaines touchent les enfants, notamment un groupe de maladies connues sous le nom de maladie de Batten (également appelée céroïde-lipofuscinose neuronale, ou CLN, en termes médicaux).
La maladie de Batten est une maladie génétique (héréditaire) rare qui touche entre 1 et 35 enfants sur 500 000 naissances. Comme c’est le cas d’autres maladies neurodégénératives, elle endommage le système nerveux central (cerveau et moelle épinière) de sorte que les cellules de cette partie du corps cessent de fonctionner correctement ou meurent. Les enfants atteints de la maladie de Batten naissent souvent en bonne santé et se développent normalement jusqu’à ce que des symptômes tels que la perte de la vision, la perte de la motricité et des crises d’épilepsie apparaissent, ce qui se produit généralement entre trois et treize ans (mais parfois même avant). À mesure que la maladie progresse, les enfants deviennent aveugles, incapables de marcher, de parler ou d’avaler et sont souvent confinés à un fauteuil roulant ou alités.
« Il n’existe actuellement aucun remède à la maladie et très peu de traitements », explique le Dr Robert Huber, professeur agrégé au Département de biologie de l’Université Trent, qui étudie les mutations génétiques associées à la maladie de Batten. « Bien que l’espérance de vie ait tendance à dépendre de l’âge auquel les symptômes se manifestent, la maladie finit par être fatale. »
La maladie de Batten est complexe du fait qu’elle est causée par une mutation dans l’un des 13 gènes agissant sur la céroïde-lipofuscinose neuronale, chacun étant associé à un sous-type différent de la maladie (CLN1, CLN2, etc.). Ainsi, une mutation du gène CLN3 provoque le sous-type CLN3 de la maladie de Batten. Les sous-types s’accompagnent généralement des mêmes symptômes, mais diffèrent sur les plans de la gravité et de l’âge d’apparition des symptômes.
Pour leur part, le Dr Huber et son équipe étudient le sous-type CLN5. « Par le passé, ce sous-type était relativement peu étudié, et le rôle cellulaire de la protéine CLN5 était mal compris, explique le Dr Huber. En outre, il est de plus en plus évident que l’étude d’une forme de la maladie de Batten peut apporter un nouvel éclairage sur d’autres formes. L’utilité de nos travaux ne se limiterait donc pas au sous-type CLN5. »
La gestion des déchets cellulaires
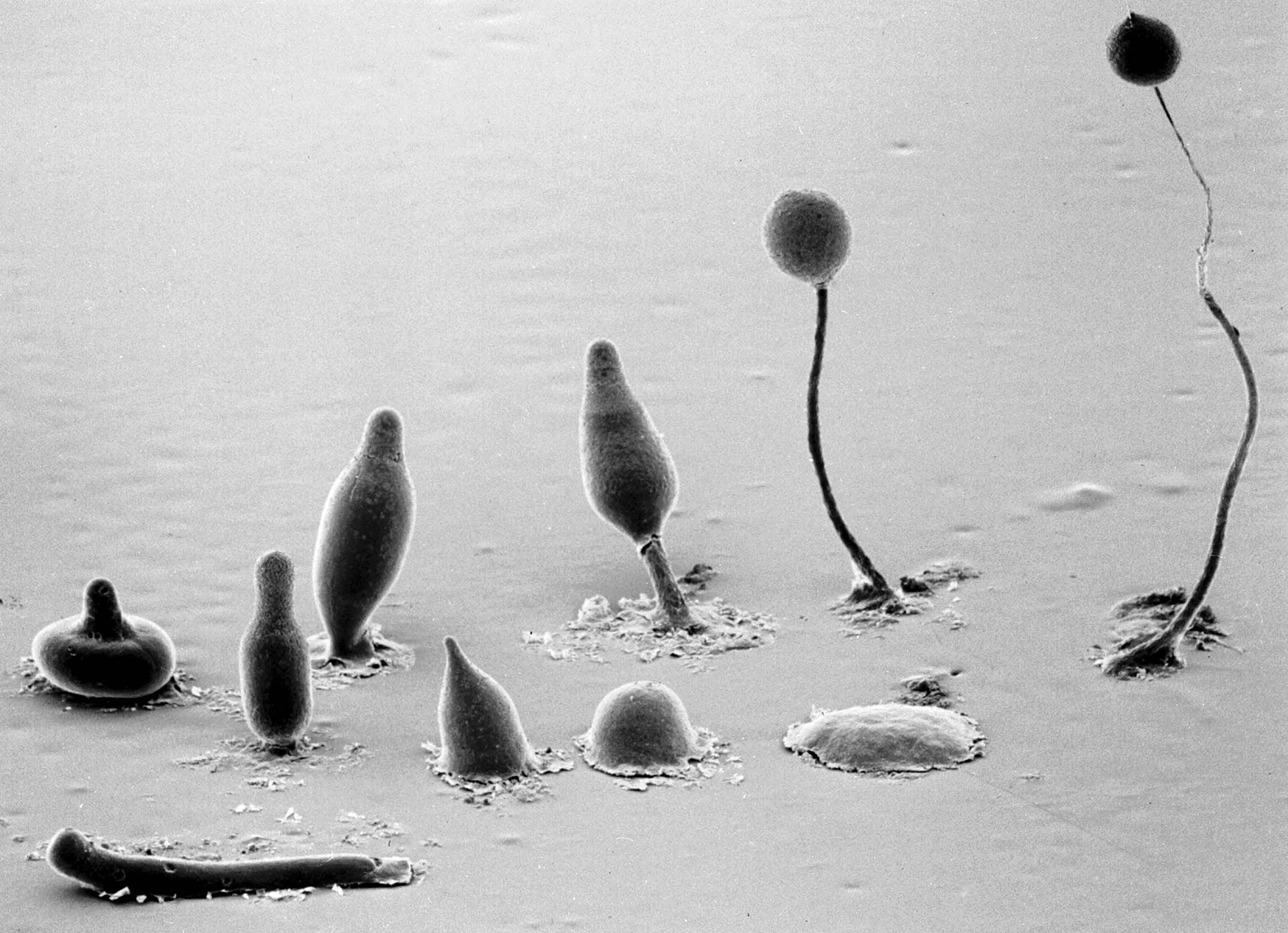
Photo : Grimson et Blanton, Université Texas Tech
Les recherches du Dr Huber visent à comprendre comment les mutations du gène CLN5 conduisent à la maladie de Batten.
« Ce que nous savons, c’est que le gène CLN5 donne aux cellules des instructions sur la façon de produire la protéine CLN5, et que cette protéine joue un rôle important dans la décomposition de la matière cellulaire », explique-t-il.
La décomposition et la production de déchets constituent des fonctions normales des cellules. Toutefois, ces dernières doivent également se débarrasser de ces déchets, faute de quoi l’accumulation risque d’entraver leur fonctionnement.
En ce qui a trait à la maladie de Batten, c’est la gestion des déchets cellulaires qui fait défaut. Soit la matière ne peut pas être décomposée efficacement, soit les déchets ne peuvent pas être éliminés des cellules. Autrement dit, le lysosome, une partie de la cellule qui agit normalement comme un broyeur d’ordures, ne fait pas (ou ne peut pas faire) son travail. Au fil du temps, l’accumulation de matière nuit aux cellules à tel point que les symptômes de la maladie commencent à apparaître.
« Étant donné que la protéine CLN5 joue un rôle dans la régulation du fonctionnement du lysosome, les mutations du gène CLN5 finissent par avoir une incidence sur la manière dont la cellule traite et décompose la matière, explique le Dr Huber. Cela dit, il faut pousser les recherches pour vraiment comprendre ce qui se passe et pourquoi. »
L’un des moyens d’étudier ce genre de fonctions cellulaires consiste à utiliser, voire à manipuler, un « organisme modèle » pour observer certains processus génétiques et cellulaires. Le laboratoire du Dr Huber utilise un microbe présent dans le sol appelé Dictyostelium discoideum, qui fait partie de la famille des amibes sociales.
« Cet organisme en particulier est utilisé depuis près d’un siècle pour étudier et comprendre un large éventail de processus cellulaires, poursuit le Dr Huber. Il est facile à cultiver et à manipuler génétiquement et contient de nombreux gènes semblables à ceux associés aux maladies humaines. »
L’un de ces gènes est CLN5. C’est ainsi que le Dr Huber et son équipe ont découvert que la protéine CLN5 joue un rôle essentiel dans la régulation du fonctionnement du lysosome. Son équipe peut donc effectuer des mutations génétiques dans l’amibe qui reproduisent celles observées chez les patients atteints de la maladie de Batten afin d’étudier la manière dont elles modifient le comportement cellulaire.
La voie vers des thérapies ciblées

Il y a plusieurs années, il a été signalé que la protéine CLN5 se trouvait non seulement à l’intérieur de la cellule, mais aussi à l’extérieur. Le Dr Huber et son équipe ont approfondi cette découverte et leurs travaux ont permis de démontrer que la protéine CLN5 est effectivement l’une des six protéines CLN libérées par les cellules. Les recherches du Dr Huber visent maintenant à comprendre pourquoi la protéine CLN5 est libérée, d’autant plus que l’on sait que cette protéine est nécessaire à l’intérieur de la cellule, et comment ce processus est lié à la maladie.
« Nous pensons que la libération de la protéine CLN5 est normale. Ce que nous cherchons maintenant à comprendre, c’est le pourquoi du comment, explique le Dr Huber. La protéine fonctionne-t-elle en dehors de la cellule? L’activité de la protéine à l’extérieur de la cellule est-elle à l’origine de la maladie CLN5? Ou bien la libération de la protéine l’empêche-t-elle de remplir sa fonction normale à l’intérieur des cellules, dans le lysosome? Dans ce cas, pouvons-nous la confiner à l’intérieur de la cellule ou réduire la quantité libérée? »
Les réponses à ces questions, ainsi que la découverte du rôle exact de CLN5 dans la gestion des déchets, devraient permettre de mettre au point des thérapies ciblées afin de corriger ou de minimiser les effets des mutations à l’origine de la maladie de Batten.
Parallèlement, l’équipe du Dr Huber fait également des essais pour déterminer si des médicaments ou des composés déjà approuvés pour traiter d’autres maladies pourraient s’avérer efficaces contre la maladie de Batten. Dans cette optique, l’équipe supprime le gène CLN5 de l’amibe, de sorte qu’elle commence à présenter un comportement cellulaire anormal. « L’objectif est d’appliquer ensuite l’un de ces médicaments ou composés aux cellules pour voir si cela leur permet de fonctionner normalement, explique le Dr Huber. Il s’agit d’une partie importante de notre recherche : la manipulation du gène nous permet de mieux comprendre la biologie de la protéine CLN5, certes, mais surtout, le fait de voir si le médicament ou le composé peut rétablir le comportement normal des cellules pourrait nous rapprocher d’un traitement. »
Changer le cours des choses pour les familles

Le Dr Huber et son équipe de recherche travaillent avec le Dr Stéphane Lefrançois à l’Institut national de la recherche scientifique et à l’Université McGill. Le Dr Lefrançois effectue les mêmes manipulations génétiques que le Dr Huber dans ses recherches, mais dans des cellules humaines.
« Il est à souhaiter que les constatations soient similaires dans les deux cas et que nous puissions combiner ces données pour faire la lumière sur ce qui se passe dans les cellules des patients », déclare le Dr Huber. L’étape suivante consistera à appliquer les enseignements tirés de l’amibe et des cellules humaines aux cellules des patients atteints de la maladie de Batten. « Nous commençons par la recherche fondamentale afin d’enrichir nos connaissances sur la protéine CLN5, puis nous nous appuyons sur cette base pour nous rapprocher encore plus des réponses et des traitements. »
Le Dr Huber mentionne recevoir parfois des courriels de familles confrontées à la maladie de Batten qui le remercient pour son travail, même si elles savent que les résultats de la recherche risquent de ne pas arriver à temps pour sauver leur enfant.
« Ces courriels sont très motivants et nous rappellent que les gens apprécient ce que nous faisons. Le message est sans équivoque : notre travail peut changer le cours des choses. Le facteur humain est primordial, et c’est ce qui nous incite à continuer de chercher des moyens d’aider les personnes atteintes de la maladie de Batten et leur famille, en plus de mettre en exergue l’importance d’investir dans la recherche sur les maladies rares. La maladie de Batten est dévastatrice pour les familles touchées, et nous sommes résolus à poursuivre nos efforts pour découvrir l’origine de la maladie. »
Lectures connexes
- Site Web du laboratoire du Dr Huber (en anglais seulement)
- Article de l’Université Trent sur les avancées du Dr Huber relatives à la maladie de Batten (en anglais seulement)
- Article de l’Université Trent sur un stage doctoral à l’Université Harvard axé sur la recherche dans le domaine des maladies neurodégénératives (en anglais seulement)
- Date de modification :